Тепловой взрыв. Под тепловым взрывом (или тепловым самовоспламенением) обычно понимают процесс развития химических реакций, протекающих с достаточно большим выделением тепла, характеризующихся достаточно высокой энергией активации и заканчивающихся появлением пламени. Количественная теория теплового самовоспламенения разработана Н.Н. Семеновым в 1928… 1940 гг.
В общем случае тепловая теория относится не только к процессам самовоспламенения, но и к зажиганию горючих газовых смесей и ко всем видам распространения пламени. Основной идеей тепловой теории является представление о наличии обратной связи между химической реакцией и выделяемым сю теплом.
В смеси, состоящей из горючего вещества и окислителя, реакция всегда протекает по определенным кинетическим законам. Скорость этой реакции w возрастает с увеличением температуры по закону Аррениуса:
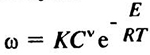 , (9.2)
, (9.2)
где К — константа скорости горения: С — концентрация окислителя; v — порядок реакции; R — универсальная газовая постоянная, Дж • моль-1 • К1-1; Т — температура смеси. К; Е — энергия активации, Дж • моль 1.
Так, скорость процесса эмульсионной полимеризации увеличивается с повышением температуры. Общая энергия активации процесса составляет 80…90 кДж/моль. При данном значении Е скорость процесса полимеризации увеличивается в 2…3 раза при возрастании температуры реакции на 10 °С.
Входящая в уравнение (9.2) энергия активации представляет собой энергию, необходимую для внутренней перестройки молекул, вступающих в реакцию. Для сложных химических реакций, к которым относятся все химические превращения в процессах горения, зависимость скорости брутто-реакции от температуры определяется либо энергией активации самой медленной элементарной реакции, либо комбинацией значений энергий активации отдельных элементарных стадий.
В ходе протекания экзотермического превращения выделяется тепло q1, пропорциональное скорости реакции, и вещество разогревается. При этом в зависимости от интенсивности химической реакции и условий теплообмена с внешней средой возможны следующие варианты развития процесса.
1. Если реакция идет достаточно медленно и, значит, скорость тепловыделения невелика, стенки реакционного сосуда успевают выделяющееся тепло отводить в окружающую среду. В результате этого при некоторой температуре, лишь немного превышающей температуру окружающей среды, устанавливается тепловое равновесие между реагирующей системой и внешней средой, при котором q1 = q2 (q2 — тепло, отводимое через стенки сосуда в окружающую среду).
2. Если начальная температура реагирующей системы достаточно высока и выделяющееся тепло не успевает отводиться во внешнюю среду, то всегда q1 > q2. В этих условиях наблюдается процесс быстрого повышения температуры реагирующей системы, заканчивающийся появлением пламени. Этот процесс мы и воспринимаем как самовоспламенение, или взрыв.
Обозначив тепловой эффект реакции через Q, для скорости тепловыделения при превращении горючей смеси имеем
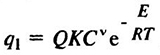 , (9.3)
, (9.3)
Тепло, выделяющееся при реакции, расходуется на нагрев реакционной смеси и на теплопотери через стенки реакционного сосуда в окружающую среду. Приняв, что теплопередача от реагирующей системы к стенкам осуществляется только теплопроводностью (конвекционные потоки и турбулентный теплоперенос отсутствуют), получаем
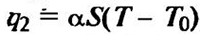 , (9.4)
, (9.4)
где а — коэффициент теплопередачи, Дж • К 1 • см-2 • с-1; S — поверхность стенок сосуда, см2; Т0 — температура стенок сосуда.
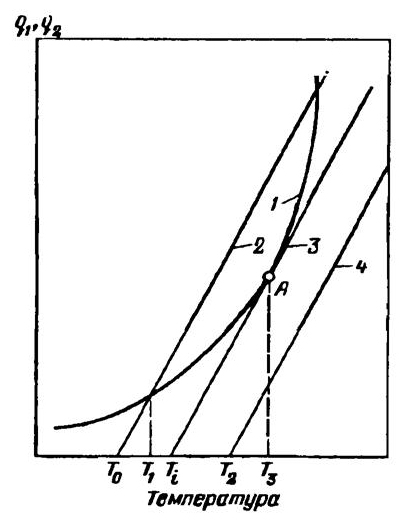
Рис. 9.2. Зависимость тепловыделения и теплоотвода при тепловом взрыве: 1 — тепловыделение; 2,3,4 — теплоотвод
Основной задачей теории самовоспламенения является определение условий, при которых начинается процесс горения. Для выяснения этого рассмотрим рис. 9.2, на котором представлены зависимости скорости тепловыделения и теплоотвода от температуры смеси. При Т = T0 скорость теплоотвода равна нулю. Хотя при этой температуре скорость тепловыделения еще невелика, реагирующая система начинает нагреваться с повышением температуры, и значения q1 и q2 возрастают. При температурах, меньших Т1 (как видно из графика), тепловыделение превышает теплоотвод. По достижении температуры Т1 величины q1 и q2 становятся равными. Вследствие этого температура реагирующей системы становится постоянной, а состояние системы — устойчивым. Если в результате воздействия каких-либо причин температура реагирующей системы несколько превысит Т1, теплоотвод окажется больше тепловыделения, излишек тепла будет передан через стенки в окружающее пространство, и система возвратится в равновесное состояние. Подобным же образом реагирующая система, искусственно охлажденная ниже температуры Т1, нагреется за счет тепла протекающей реакции.
При повышении начальной температуры реакционного сосуда тепловыделение по-прежнему будет описываться кривой 1, а прямая теплоотвода переместится вправо параллельно самой себе. При начальной температуре T2 вся кривая тепловыделения располагается выше прямой теплоотвода 4, соответствующей этой температуре. В данных условиях температура реагирующей системы, а вместе с ней и скорость реакции будут прогрессивно увеличиваться. Явление перехода от медленно протекающей реакции, сопровождаемой незначительным разогревом, к прогрессивно ускоряющемуся выгоранию смеси и представляет собой тепловое самовоспламенение, или тепловой взрыв.
Начальная температура T1, для которой прямая теплоотвода 3 есть касательная к кривой тепловыделения (точка А на рис. 9.2), является предельной для перехода от режима стационарной реакции к тепловому самовоспламенению. Температура T1 является критической температурой самовоспламенения.
Картина, аналогичная рассмотренной, получается в том случае, когда условия теплообмена (т. е. начальная температура реагирующей системы) остаются неизменными, а скорость реакции изменяется в результате изменения соотношения исходных компонентов или начального давления.
Рассмотрим количественные соотношения, характеризующие тепловое самовоспламенение.
В точке касания кривых тепловыделения и теплоотвода значения q1 и q2 и их производные по температуре равны. Таким образом, при критическом условии будут справедливы следующие соотношения:
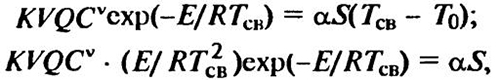 , (9.5-6)
, (9.5-6)
где V — объем реакционного сосуда; ТСв — температура самовоспламенения
Разделив левые и правые части этих уравнений, получим
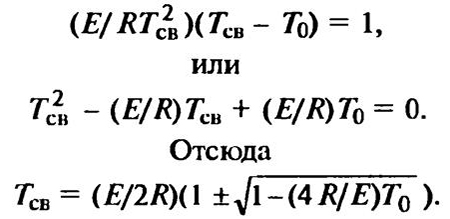 , (9.7-9)
, (9.7-9)
Поскольку интерес представляет и минимальная температура самовоспламенения, то из двух возможных решений выбираем
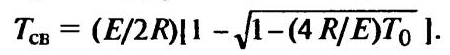 , (9.10)
, (9.10)
Учитывая, что T0 << E/(2r), подкоренное выражение заменяем разложением в ряду и ограничиваемся тремя первыми членами разложения:
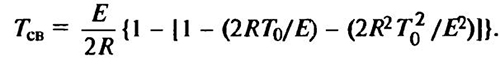 , (9.11)
, (9.11)
Окончательно получаем
Тсн = Т0+ RT02/E, (9.12)
Из уравнения (9.12) видно, что температура самовоспламенения незначительно отличается от начальной температуры стенки реакционного сосуда. Поэтому часто вместо тсв используют T0 (при е = 83,8 кДж • моль-1 и T0 = 1000 К величина допускаемой при этом ошибки не превышает 2%).
Величина RT02/E характеризует необходимый нагрев реагирующей смеси от температуры, при которой происходит нарушение теплового равновесия и следует тепловой взрыв. Таким образом, условие теплового взрыва сводится к начальному саморазогреву смеси, превышающему некоторое критическое
значение величины RT02/E.
Уравнение (9.6), которое с учетом сказанного можно представить в виде
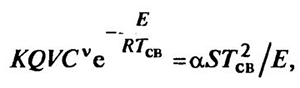 , (9.13)
, (9.13)
устанавливает связь между составом смеси и критическими условиями самовоспламенения.